Une myélopathie aiguë se révèle par un déficit moteur rapidement progressif voire soudain, associé à des troubles sensitifs et sphinctériens. L’IRM en urgence est indispensable pour éliminer une lésion nécessitant une attitude thérapeutique spécifique (compression extramédullaire, tumeur médullaire ou malformation artério-veineuse en particulier). Ces diagnostics écartés, de nombreuses pathologies peuvent être responsables de myélopathie aiguë ; parmi celles-ci, l’infarctus médullaire et la myélite inflammatoire.
Protocoles d'IRM
Une atteinte médullaire aiguë est une urgence diagnostique devant être explorée par une IRM médullaire comportant une injection de Gadolinium et complétée par des séquences centrées sur l'encéphale.
L’étude doit explorer la moelle, depuis la jonction bulbo-médullaire jusqu’aux racines de la queue de cheval du cul de sac dural.
Les séquences sagittales T1 et T2 et les coupes axiales T2 sur l’ensemble de la moelle sont donc indispensables.
Une séquence de diffusion est intéressante y compris en urgence, tandis que l’utilité d’une imagerie en tenseur de diffusion est en évaluation.
La séquence sagittale T1 est à répéter après injection de Gadolinium complétée par des coupes axiales centrées sur des zones anormales éventuellement détectées.
L’étude cérébrale peut se limiter aux séquences axiale T1 injectée, axiale diffusion et T2 type TSE (ou FLAIR après l’âge de 2 ans) pour chercher des anomalies ischémiques ou inflammatoires permettant d’orienter le diagnostic.
De la qualité de cette imagerie dépend la fiabilité de l’interprétation. En urgence, il s'agit donc d'un examen de réalisation délicate et il peut être nécessaire de répéter l’IRM 48 h après si le premier examen est normal ou douteux. Un nouveau bilan médullaire est également conseillé à distance (par exemple après une semaine d’évolution clinique) pour juger de l’évolution lésionnelle.
Infarctus médullaire
L'abondance des anastomoses artérielles rend l'infarctus médullaire rare par rapport aux infarctus cérébraux. Chez l’adulte, il représente 1% des admissions pour AVC (1). Chez l’enfant, il n’existe pas de données épidémiologiques et la plus grosse série réunit 83 observations (2).
Anatomie et physiopathologie
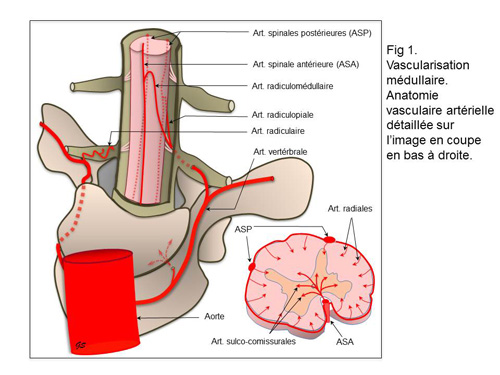
La vascularisation de la moelle épinière (figure 1) est assurée par une artère spinale antérieure médiane et deux artères postérieures latérales (3). L'artère spinale antérieure alimente la partie profonde de la moelle par des artères perforantes terminales sulco-comissurales. Les artères spinales postérieures alimentent la surface de la moelle avec un riche réseau anastomotique d’où partent de petites perforantes radiales. Une ischémie médullaire se produit majoritairement par atteinte de l'artère spinale antérieure (4).
L'artère spinale antérieure est alimentée par 4 à 8 artères radiculo-médullaires qui suivent les racines nerveuses ventrales. L'artère radiculo-médullaire principale (dite d’Adamkiewicz) provient généralement du côté gauche à hauteur de T8-10. Les artères spinales postérieures proviennent de 10 à 20 artères radiculo-piales qui suivent les racines nerveuses dorsales. Toutes ces artères, sont elles-mêmes issues des artères vertébrales cervicales, intercostales et lombaires qui vascularisent le corps vertébral. En cas de myélopathie aiguë, un infarctus osseux est ainsi un argument en faveur de l’origine ischémique (5).
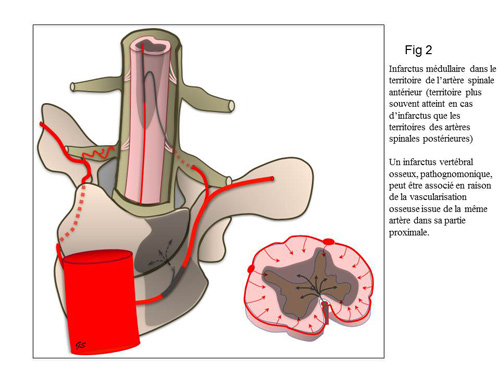
Le premier type d’infarctus médullaire est lié à une ischémie globale secondaire à un bas débit sanguin systémique (arrêt cardiaque, hypotension sévère, choc hypovolémique…). Dans ce cas, l'ischémie prédomine dans la substance grise (région centrale) et sur le territoire dorso-lombaire (zones moins bien vascularisées) (6). Le second type est une ischémie focale sur le territoire d'une artère médullaire, le plus souvent d’Adamkiewicz (figure 2). Dans ce cas, l'ischémie prédomine dans les deux tiers antérieurs. L’ischémie spinale postérieure, beaucoup plus rare, prédomine à la face postérieure de la moelle. Le territoire atteint est alors localisé à la jonction dorso-lombaire (4, 6-9).
Caractéristiques cliniques des infarctus médullaires chez l’enfant
L’âge moyen de présentation est de 11 ans avec deux pics : 2-6 ans puis l’adolescence.
Les symptômes dépendent de l'étendue longitudinale et transversale de l'ischémie (10). Des douleurs vertébrales précèdent le déficit neurologique dans un tiers des cas, avec parfois des paresthésies associées (2). Ces douleurs sont surtout rapportées après traumatisme mineur chez des adolescents, parfois décalées de plus de 12 h du déficit. Les troubles neurologiques sont d’apparition soudaine ou rapidement progressive. Des épisodes précédents de déficits neurologiques transitoires médullaires sont parfois rapportés (9, 11).
L’atteinte classique est le syndrome spinal antérieur caractérisé par une para- ou tétraplégie douloureuse soudaine avec déficit sensoriel thermo-algique sous-lésionnel + troubles sphinctériens contrastant avec une sensibilité profonde peu affectée (2). Le niveau lésionnel est souvent dorso-lombaire. Un syndrome de Brown-Séquard incomplet est dû à une atteinte médullaire unilatérale. Le syndrome spinal postérieur est plus rare. Généralement l’atteinte bilatérale entraîne des paresthésies et troubles de la sensibilité profonde sous-lésionnels diffus, parfois avec symptômes moteurs et spino-thalamiques en cas d'extension antérieure de l'infarctus. Dans les très rares cas d’atteinte unilatérale, le syndrome de Brown-Séquard est incomplet, c’est à dire sans atteinte thermo-algique.
Imagerie
Elle recherche un hypersignal T2 dans un territoire artériel. L’hypersignal T2 des deux tiers antérieurs de la moelle sur la séquence sagittale avec aspect d’« œil de hibou » sur les coupes axiales T2 évoque une ischémie spinale antérieure. Des hypersignaux T2 postérieurs périphériques signent une atteinte du territoire spinal postérieur. Les séquences pondérées en diffusion peuvent montrer une restriction de diffusion (11, 13-16). En raison de la forte anisotropie de la moelle épinière, la diffusivité radiale doit cependant être calculée pour différencier une atteinte inflammatoire d’une atteinte ischémique. En effet, les séquences classiques de diffusion en acquisition sagittale ne permettent pas de différencier ces deux entités de façon certaine.
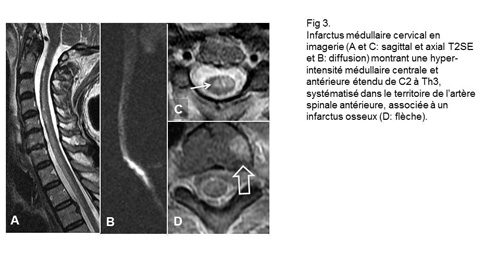
Un infarctus osseux hémivertébral en signal hyperintense sur les séquences d'inversion-récupération T2 (figure 3) est pathognomonique de l’ischémique artérielle (5). La perte de l’hypersignal T2 physiologique d’un ou de plusieurs espaces intervertébraux suggère un embole fibrocartilagineux discal à l’origine de l’ischémie (17-18).
Les investigations étiologiques sont l’angioscanner ou l’angio-IRM aortique pour chercher une maladie inflammatoire ou une dissection aortique. En cas d’infarctus cervical ou thoracique supérieur, une imagerie des troncs supra-aortiques cherche une pathologie des artères vertébrales (dissection ou occlusion le plus souvent). Chez l’enfant, les séquences en temps de vol (TOF) permettent une analyse plus aisée, car les dissections peuvent être très focales et intéresser les jonctions V2-V3 difficiles à analyser après injection de Gadolinium du fait de la superposition des plexus veineux avoisinants (19). Il est aussi habituel de chercher une cause cardiaque et un facteur biologique de thrombose.
Etiologie
Chez l’adulte, les causes sont diverses (10), notamment iatrogènes (chirurgie aortique et thoracique, artériographie, anesthésie spinale et épidurale, infiltrations d’anti-inflammatoires foraminales). Chez l’enfant, Stettler (2) retrouve l’hypotension systémique rapportée à une pathologie cardiaque ou secondaire à un acte chirurgical comme déterminant important. Des traumatismes mineurs, parfois associés à une embolie fibrocartilagineuse, sont aussi rapportés (18, 20, 21). Un quart des situations restent de cause indéterminée.
Devenir
Une mortalité de 10-20% est rapportée à la phase aiguë chez l’adulte (4, 6, 9), la plupart du temps au cours des infarctus médullaires cervicaux. Des séquelles invalidantes sont notées chez 50-60% des survivants (4, 6, 8), avec paraplégie et troubles sphinctériens persistants. Stettler (2) rapporte une mortalité de 4%, une absence d’amélioration chez 12% des enfants et une guérison complète dans 5% des cas. Une marche autonome ou avec aide est recouvrée dans 30 et 50 % des cas. L’évolution des troubles sphinctériens parait meilleure avec 40% de disparition des signes. L’évolution des troubles sensitifs comme la persistance de douleurs parfois invalidantes est mal connue. L’évolution motrice parait meilleure quand le déficit moteur initial n’est pas total.
Il n’existe pas de corrélation entre le devenir et le niveau lésionnel initial en imagerie. Cependant, l’IRM pondérée en diffusion avec calcul de la fraction d’anisotropie semble un déterminant pronostique chez les patients présentant une atteinte initiale sévère (22).
Traitement
Aucun traitement médicamenteux n’a été évalué. Dans la pratique, un traitement antiplaquettaire, le maintien de la pression artérielle moyenne à un niveau correct, la prévention des complications de décubitus et la rééducation sont indiqués.
Références
- 1. Sandson TA, Friedman JH. Spinal cord infarction. Report of 8 cases and review of the literature. Medicine (Baltimore). 1989;68:282-92. Review.
- 2. Settler S, El-Koussy M, Ritter B, Boltshauser E, Jeannet PY, Kolditz P, Meyer-Heim A, Steilin M. Non-traumatic spinal cord ischaemia in childhood – clinical manifestation, neuroimaging and outcome. Eur J Paediatr Neurol. 2013;17:176-84.
- 3. Lasjaunias P, Berenstein A, Ter Brugge KG (2001). Surgical Neuroangiography: Clinical Vascular Anatomy and Variations. Springer, Paris, pp. 73-160.
- 4. Masson C, Pruvo JP, Meder JF, Cordonnier C, Touzé E, De La Sayette V, Giroud M, Mas JL, Leys D; Study Group on Spinal Cord Infarction of the French Neurovascular Society. Spinal cord infarction: clinical and magnetic resonance imaging findings and short term outcome. J Neurol Neurosurg Psychiatry. 2004;75:1431-5.
- 5. Faig J, Busse O, Salbeck R. Vertebral body infarction as a confirmatory sign of spinal cord ischemic stroke: report of three cases and review of the literature. Stroke. 1998;29:239-43. Review.
- 6. Robertson CE, Brown RD Jr, Wijdicks EF, Rabinstein AA. Recovery after spinal cord infarcts: long-term outcome in 115 patients. Neurology. 2012 Jan 10;78(2):114-21.
- 7. Nedeltchev K, Loher TJ, Stepper F, Arnold M, Schroth G, Mattle HP, Sturzenegger M. Long-term outcome of acute spinal cord ischemia syndrome. Stroke. 2004;35:560-5.
- 8. New PW, McFarlane CL. Retrospective case series of outcomes following spinal cord infarction. Eur J Neurol. 2012;19:1207-12.
- 9. Cheshire WP, Santos CC, Massey EW, Howard JF Jr. Spinal cord infarction: etiology and outcome. Neurology. 1996;47:321-30.
- 10. Saliou G, Théaudin M, Join-Lambert Vincent C, Souillard-Scemama R (2014). Practical Guide to Neurovascular Emergencies. Springer, Paris, pp. 165-170.
- 11. Palisis S, Hayes LL. Acquired pathology of the pediatric spine and spinal cord. Pediatr Radiol. 2015;45 Suppl3):S420-S432.
- 12. Nelson JA, Ho CY, Golomb MR. Spinal cord stroke presenting with acute monoplegia in a 17-year -old tennis player. Pediatr Neurol 2016;56:76-9.
- 13. Tanenbaum LN. Clinical applications of diffusion imaging in the spine. Magn Reson Imaging Clin N Am. 2013;21:299-320.
- 14. Kuker W, Weller M, Klose U, Krapf H, Dichgans J, Nägele T. Diffusion-weighted MRI of spinal cord infarction--high resolution imaging and time course of diffusion abnormality. J Neurol. 2004;251:818-24.
- 15. Andre JB, Zaharchuk G, Saritas E, Komakula S, Shankaranarayan A, Banerjee S, Rosenberg J, Nishimura DG, Fischbein NJ. Clinical evaluation of reduced field-of-view diffusion-weighted imaging of the cervical and thoracic spine and spinal cord. AJNR. 2012;33:1860-66.
- 16. Reynolds JM, Belvadi YS, Kane AG, Poulopoulos M. Thoracic disc herniation leads to anterior spinal artery syndrome demonstrated by diffusion-weighted magnetic resonance imaging (DWI): a case report and literature review. Spine J. 2014;14:e17-22.2013 Nov 16.
- 17. Mateen FJ, Monrad PA, Hunderfund AN, Robertson CE, Sorenson EJ. Clinically suspected fibrocartilaginous embolism: clinical characteristics, treatments, and outcomes. Eur J Neurol. 2011;18:218-25.
- 18. Reisner A, Gary MF, Chern JJ, Grattan-Smith JD. Spinal cord infarction following minor trauma in children: fibrocartilaginous embolism as a putative cause. J Neurosurg Pediatr. 2013;11:445-50.
- 19. Simonnet H, Deiva K, Bellesme C, Cabasson S, Husson B, Toulgoat F, Théaudin M, Ducreux D, Tardieu M, Saliou G. Extracranial vertebral artery dissection in children: natural history and management. Neuroradiology. 2015;57:729-38.
- 20.Nance JR, Golomb MR. Ischemic spinal cord infarction in children without vertebral fracture. Pediatr Neurol 2007;36:209-216.
- 21. Raghavan A, Onikul E, Ryan MM, Prelog K, Taranath A, Chennapragada M. Anterior spinal cord infarction owing to possible fibrocartilainous embolism. Pediatr Radiol. 2004;34:503-506.
- 22. Théaudin M, Saliou G, Denier C, Ducreux D. A correlation between fractional anisotropy variations and clinical recovery in spinal cord infarctions. J Neuroimaging 2013;23:256-8.
Myélite inflammatoire : myélite aigue transverse
Le terme de myélite suggère une origine inflammatoire qui peut se rencontrer dans des affections infectieuses (enterovirose), postinfectieuses (encéphalomyélite aigue disséminée), démyélinisantes chroniques (sclérose en plaques) ou au cours de maladies systémiques (lupus érythémateux disséminé). Les critères diagnostiques définissant le caractère inflammatoire du processus de myélite aigue transverse (MAT) proposés en 2002 par l’Académie Américaine de Neurologie et le groupe de travail sur la myélite aigue transverse (1) incluent :
- Un liquide cérébrospinal inflammatoire (>10 cellules/mm3 ou bandes oligoclonales) ou un réhaussement des lésions médullaires sans infection identifiée du système nerveux central.
- Horaire d’installation du déficit maximal supérieur à 4 h et inférieur à 21 j.
- Le terme transverse illustre le niveau, typiquement en bande, de l'atteinte sensitive.
Des études spécifiquement pédiatriques (2-5) ont cependant montré que les critères inflammatoires pouvaient manquer malgré un tableau clinique typique.
L'incidence annuelle de la MAT chez l'enfant de moins de 16 ans est estimée à 2/1 000 000 et représente 20% des MAT (2, 5).
Caractéristiques cliniques
La MAT se rencontre plutôt avant 3 ans ou après 10 ans (3, 5). Dans la moitié des cas, un épisode fébrile précède d’une dizaine de jour les signes neurologiques (3).
Les troubles sensitifs sont révélateurs dans la quasi totalité des cas associés à des troubles de la marche et urinaires, également quasi constants (3). Une douleur dorsale est rapportée 60-75% des cas (2).
Ce tableau clinique étant proche de celui de l’infarctus médullaire, il est important de rechercher soigneusement une pathologie d’allure virale survenue peu de temps avant l’épisode neurologique et l’absence de tout traumatisme. L’interrogatoire minutieux doit faire également préciser le moment d’apparition et l’évolution initiale des déficits, souvent plus soudains en cas d’ischémie.
Imagerie
L’hypersignal T2 intramédullaire sans systématisation artérielle est le signe le plus constant (>80%) (6). Il peut être unique, alors souvent thoracique, ou multiple (30-50%). Sur les coupes sagittales, ces hypersignaux T2 sont plutôt étendus, leur hauteur dépassant deux corps vertébraux dans la majorité des cas (6). Une hauteur dépassant trois corps vertébraux définit la myélite longitudinale extensive (5-7). Sur les coupes axiales, l’hypersignal est central avec une atteinte périphérique variable souvent symétrique (6) et occupant typiquement plus des deux tiers de la surface médullaire.
Les zones d'élargissement de la moelle (40-50%) sont bien visibles sur les séquences sagittales, entraînant une diminution des espaces liquidiens périmédullaires (6, 8). Les prises de contraste intramédullaires (20-30%) sont d'intensité souvent modérée (6). Les lésions peuvent apparaitre en hyposignal T1 (1/3) (5).
Cet hyposignal serait de mauvais pronostic.
Les éléments négatifs sont la normalité de signal de l’ensemble des corps vertébraux et des disques intervertébraux ainsi que l’absence de cavité syringomyélique, celle-ci étant toutefois exceptionnelle chez l’enfant. Une IRM médullaire initiale normale (5-20%) doit faire répéter l’examen dans les 24 à 48 h, certaines anomalies pouvant être alors mieux visibles. L'IRM cérébrale est normale en cas de MAT. La présence d'hypersignaux T2 cérébraux augmente de façon significative le risque d'une myélite révélant une sclérose en plaques ou une neuromyélite optique de Devic (9).
Les diagnostics différentiels sont parfois facilement écartés
Dans la sclérose en plaques, les hypersignaux T2 médullaires sont limités en hauteur et des plaques cérébrales sont typiques. Mais l’atteinte médullaire peut être isolée dans 20% des scléroses en plaques (10). Dans la neuromyélite optique, des auto-anticorps de l'Aquaporine 4 peuvent être présents. Il peut exister des hypersignaux T2 typiques des nerfs optiques et des régions postérieures du tronc cérébral. Des hypersignaux étendus de la subtance blanche hémisphérique avec atteinte des noyaux gris centraux évoquent une encéphalomyélite aigue disséminée. L’isolement direct, par sérologies ou PCR d'un germe (virus, bactérie ou champignon) affirme le diagnostic de myélite infectieuse.
Quelques autres causes plus rares ont été rapportées : déficit en vitamine 12, maladie métabolique comme la maladie d'Alexander ou certaines cytopathies mitochondriales. Toutes ces recherches (étude du LCR, auto-anticorps, agents infectieux, déficit en vitamines en particulier) sont nécessaires avant de poser le diagnostic de MAT idiopatique.
Traitement
Les bolus de stéroides sont à discuter rapidement. Des plasmaphérèses sont réalisées dans certains centres. Des études sur l'intérêt des immunoglobulines sont en cours (5).
Evolution
La MAT idiopathique de l'enfant évolue favorablement dans la moitié des cas (5). Cependant 40% des enfants gardent un déficit moteur, sévère pour près de 30% des enfants. Des troubles sphinctériens peuvent également persister (3, 5).
Références
- 1. Transverse Myelitis Consortium Working Group. Proposed diagnostic criteria and nosology of acute transverse myelitis. Neurology 2002;59:499-505
- 2. Wolf VL, Lupo PJ, Lotze TE. Pediatric acute transverse myelitis overview and differential diagnosis. J Child Neurol 2012;27:1426-1436.
- 3. Pidcock FS, Krish nan C, Crawford TO, Salorio CF, Trovato M, Kerr DA. Acute transverse myelitis in childhood: center-based analysis of 47 cases. Neurology 2007;68:1474-1480.
- 4. Thomas T, Branson HM, Verhey LH et al. The demographic, clinical and magnetic resonance imaging (MRI) features of transverse myelitis in children. J Child Neurol 2012;27:11-21.
- 5. Absoud M, Greenberg BM, Lim M, Lotze T, Thomas T, Deiva K. Pediatric transverse myelitis. Neurology 2016;87 (Suppl 2):S46-S52.
- 6. Alper G, Petropoulou KA, Fitz CR, Kim Y. Idiopathic acute transverse myelitis in children: an analysis and discussion of MRI findings. Mult Scler 2011;17:74-80.
- 7. Eckart Sorte D, Poretti A, Newsome SD, Boltshauser E, Huisman TAGM, Izbudak I. Longitudinally extensive myelopathy in children. Pediatr Radiol;2015;45:244-257.
- 8. Knebusch M, Strassburg HM, Reiners K. Acute transverse myelitis in childhood: nine cases and review of the literature. Dev Med Child Neurol 1998;40:631-639.
- 9. Deiva K, Absoud M, Hemingway C, Hernandez Y, Husson B, Maurey H et al. Acute idiopathic transverse myelitis in children: early predictors of relapse and disability. Neurology;84:341-349.
- 10. Palisis S, Hayes LL. Acquired pathology of the pediatric spine and spinal cord. Pediatr Radiol. 2015;45 Suppl3):S420-S432.